إشعار السلامة الميدانية للجهاز الطبي
أجهزة العناية التنفسية ورعاية حالات اضطرابات النوم من Philips Respironics
FSN 2021-05-A وFSN 2021-06-A
في يونيو 2021، وبعد اكتشاف خطر صحي محتمل مرتبط بجزء في أجهزة CPAP معينة وأجهزة ضغط BiPAP وأجهزة التنفس الصناعي الميكانيكية، أصدرت Philips إشعارًا طوعيًا للسلامة الميدانية برقم (FSN 2021-05-A وFSN 2021-06-A).
إن سلامة المرضى هي أولويتنا القصوى، ونحن ملتزمون بدعم المرضى ومقدمي المعدات الطبية المعمّرة (DME) والموزعين وشركاء الصحة المنزلية وأخصائيي الرّعاية الصحية من خلال عملية المعالجة الكاملة.
خلال عملية معالجة هذا السحب، سنقدم الإرشادات ونشارك الخطوات التالية؛ حتى تتمكن من التأكد من حصولك على أحدث المعلومات وأكثرها دقة. نشكرك على صبرك ونحن نعمل على استعادة ثقتك.
هل جهازك غير مسجل؟
معلومات إضافية عن…

المريض


الأسئلة والأجوبة
تتأثر المنتجات الآتية المدرجة بإشعار السحب/إشعار السلامة الميدانية:
أجهزة ضغط الهواء الإيجابي المستمر (CPAP) وأجهزة ضغط الهواء الإيجابي ذات المستوى الثنائي (BiLevel PAP)
كل الأجهزة المتأثرة التي تم تصنيعها قبل 26 أبريل 2021، كل الأرقام التسلسلية للأجهزة
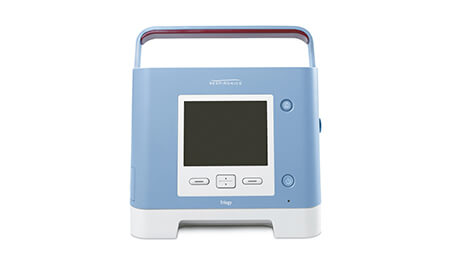
جهاز التنفس الاصطناعي المستمر، الحد الأدنى من الدعم التنفسي، الاستخدام في المنشآت
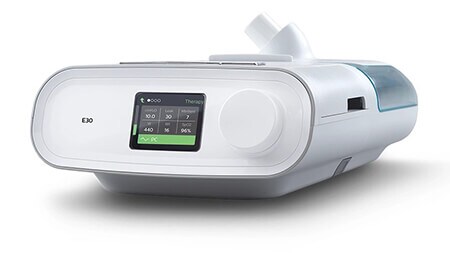
E30
(التفويض بالاستخدام الطارئ)

DreamStation ASV
يُعرف أيضًا باسمDreamStation BiPAP autoSV

DreamStation ST، وAVAPS
يُعرف أيضًا باسم DreamStation BiPAP AVAPS وDreamStation BiPAP S/T

SystemOne ASV4
يُعرف أيضًا باسم System One BiPAP autoSV وSystem One BiPAP autoSV Advanced

S/T من السلسلة C، AVAPS
يُعرف أيضًا باسم System One BiPAP AVAPS (من السلسلة C)وSystem One BiPAP S/T (من السلسلة C)

OmniLab Advanced Plus
جهاز المعايرة بالتحليل الكيميائي داخل المختبر

System One من السلسلة 50
أجهزة CPAP وCPAP التلقائية وأجهزة BiPAP

System One من السلسلة 60
أجهزة CPAP وCPAP التلقائية وأجهزة BiPAP

جهاز DreamStation CPAP وجهاز CPAP التلقائي وجهاز BiPAP

جهاز DreamStation GO CPAP وجهاز APAP وجهاز CPAP التلقائي

جهاز Dorma 400، 500وجهاز CPAP وجهاز CPAP التلقائي
(لا يتم تسويقه في الولايات المتحدة)
إذا كان جهازك متأثرًا...
جهاز التنفس الاصطناعي المستمر، الحد الأدنى من الدعم التنفسي، الاستخدام في المنشآت

A-Series BiPAP Hybrid A30
يُعرف أيضًا باسم جهاز التنفس الصناعيBiPAP Hybrid A30(من السلسلة A)
(لا يتم تسويقه في الولايات المتحدة)

جهاز التنفس الصناعي BiPAP V30، من السلسلة A
يُعرف أيضًا باسم جهاز التنفس الصناعي BAP V30 Auto(من السلسلة A)
جهاز التنفس الاصطناعي المستمر، الدعم غير اللازم للبقاء على قيد الحياة

A-Series BiPAP A40
يُعرف أيضًا باسم جهاز التنفس الصناعيBiPAP A40(من السلسلة A)
(لا يتم تسويقه في الولايات المتحدة)

A-Series Bipap A30
يُعرف أيضًا باسم جهاز التنفس الصناعيBiPAP A30(من السلسلة A)
(لا يتم تسويقه في الولايات المتحدة)
إذا كان جهازك متأثرًا...
ما المنتجات غير المتأثرة ولماذا؟
قد تحتوي المنتجات غير المتأثرة على مواد مختلفة من فوم خفض الصوت، حيث تتوفر مواد وتقنيات جديدة بمرور الوقت. وقد يتم أيضًا وضع فوم خفض الصوت في الأجهزة غير المتأثرة في مكان مختلف وفقًا لتصميم الجهاز.